北京科技大学万向元团队在作物第三代杂交育种技术-玉米多控不育技术领域取得重要进展
近日,北京科技大学化学与生物工程学院、融合创新研究院、生物前沿技术与应用研究中心万向元教授团队在国际著名TOP期刊Plant Biotechnology Journal(SCI影响因子7.443)在线发表了题为“Construction of a multi-control sterility system for a maize male-sterile line and hybrid seed production based on the ZmMs7 gene encoding a PHD-finger transcription factor”的研究论文(文章链接http://onlinelibrary.wiley.com/doi/10.1111/pbi.12786/full)。该研究首次报道了玉米隐性核不育基因ZmMs7的图位克隆和功能研究,为玉米雄花发育的分子机理研究提供了重要线索;同时,首次提出了作物多控不育技术系统(Multi-Control Sterility System)的概念,利用该技术体系生产的玉米不育系和杂交种都不含任何转基因成分,可规避转基因对人类食品安全的困扰。该研究利用ZmMs7基因及其突变体(ms7ms7)成功创建了玉米多控不育技术体系,在玉米不育系创制与杂交种生产上具有重要应用价值。
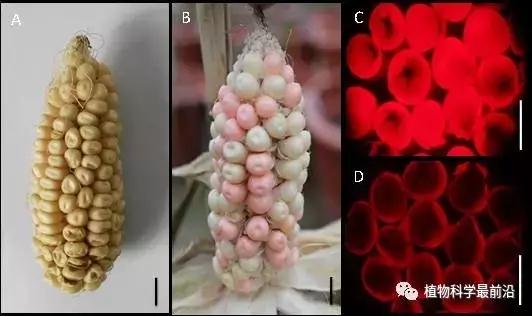
Figure Phenotype of the ZmMs7 transgenic maintainer line (T1). A and B, Ear phenotype of the maize Hi-II hybrid line (A) and transgenic event (M0701-2, B); C and D, Transgenic seeds (C) and non-transgenic seeds (D) from M0701-2 under a red fluorescence (RF) filter. T1 is the first transformation generation. Bars=1 cm.
同时,将转基因技术、花粉灭活技术、荧光种子技术、除草剂筛选技术与常规育种技术相结合,万向元团队成功地创建了玉米多控不育技术体系。其技术体系原理是通过构建含有5个功能元件(1个育性恢复基因ZmMs7、2个花粉自我降解基因ZmAA和Dam、1个红色荧光基因DsRed2或mCherry和1个抗除草剂基因Bar)的表达载体,转化玉米获得中间材料,然后通过回交转育将含有上述5个元件的T-DNA区段导入进玉米隐性核不育材料ms7中,并进一步与不同遗传背景的玉米骨干自交系结合,从而创造出比国外同类技术(SPT)更安全、更稳定的多控不育保持系和多控不育系,在玉米不育系繁殖、不育化杂交育种和制种中具有巨大的产业化应用潜力。
此外,该研究相关成果已获批两项国家发明专利:一种控制玉米雄性生育力的ZmMs7基因序列及其编码蛋白(专利号ZL201410338212.0),一种基于Ms7基因构建的多控不育表达载体及其用于保持和繁殖玉米隐性核不育系的方法(专利号ZL 201510301333.2)。
据报道,目前中国每年约有380万亩玉米杂交制种面积,每亩杂交玉米制种人工去雄成本约为260元,合计约10亿元,一旦实现多控不育杂交制种,将大大降低制种的人工成本。其次,不育化杂交制种由于不需要人工去雄,不会对玉米造成人为伤害以及充分利用雄穗生长发育的物质能量,将实现制种产量增加约50公斤/亩以上,一旦多控不育技术实现产业化应用,每年将增产玉米种子约1.9亿公斤,产生直接经济效益约38亿元。最后,由于不育化制种可以保证杂交种子的纯度(趋近100%)和强活力,隐性核不育化制种技术生产的杂交种的大田产量一般比传统杂交种具有明显的增产潜力(美国杜邦先锋已有报道)。近年来,中国玉米种植面积稳定在5亿亩左右,应用多控不育杂交种按照每亩增产50公斤玉米计,总增产商品玉米250亿公斤,总增加农民收益约500亿元。因此,该技术一旦在中国产业化应用后,将具有非常巨大的社会效益和经济效益。
该研究由北京科技大学、北京首佳利华科技有限公司、湖南农业大学和北京农林科学院玉米研究中心合作共同完成,博士生张丹凤、北京科技大学吴锁伟博士、安学丽教授、谢科博士为论文共同第一作者,万向元教授和赵久然研究员为共同通讯作者。相关工作得到了国家发改委、国家科技部、国家教育部、北京市科委、北京市海淀区等项目的资助。

Summary: Although hundreds of genetic male sterility (GMS) mutants have been identified in maize, few are commercially used due to a lack of effective methods to produce large quantities of pure male-sterile seeds. Here, we develop a multi-control sterility (MCS) system based on the maize male sterility 7 (ms7) mutant and its wild-type Zea mays Male sterility 7 (ZmMs7) gene via a transgenic strategy, leading to the utilization of GMS in hybrid seed production. ZmMs7 is isolated by a map-based cloning approach, and it encodes a PHD-finger transcription factor orthologous to rice PTC1 and Arabidopsis MS1. The MCS transgenic maintainer lines are developed based on the ms7-6007 mutant transformed with MCS constructs containing the (i) wild-type ZmMs7 gene to restore fertility, (ii) maize α-amylase gene ZmAA and/or (iii) DNA adenine methylase gene Dam to devitalize transgenic pollen, (iv) red fluorescence protein gene DsRed2 or mCherry to mark transgenic seeds, and (v) the herbicide-resistant gene Bar for transgenic seed selection. Self-pollination of the MCS transgenic maintainer line produces transgenic red fluorescent seeds and non-transgenic normal color seeds at a 1:1 ratio. Among them, all the red fluorescent seeds are male fertile, but the seeds with a normal color are male sterile. Cross-pollination of the transgenic plants to male-sterile plants propagates the male-sterile seeds with high purity. Moreover, the transgene transmission rate through pollen of transgenic plants harboring two pollen-disrupted genes is lower than that containing one pollen-disrupted gene. The MCS system has great potential to enhance the efficiency of maize male-sterile line propagation and commercial hybrid seed production.


